
Iveric Bio, Nasdaq 상장 규칙 5635(c)(4)에 따라 유도 보조금 보고

2021년 9월 2일
뉴욕, 2021년 9월 2일 --( BUSINESS WIRE ) -- IVERIC bio, Inc. (NASDAQ: ISEE)는 오늘 2021년 9월 1일 회사의 2019년 주식 유인 인센티브 계획에 따라 주식 기반 포상을 부여했다고 보고했습니다. 신입사원 3명에게. 유인금은 회사 이사회의 위임에 따라 회사의 보상 및 인재 전략 위원회에서 승인했으며 나스닥 상장 규칙 5635(c)( 4) 고용 보상의 구성 요소.
유인책은 회사 보통주 총 155,000주를 구매할 수 있는 비법정 옵션과 회사 보통주에 대한 총 12,500주 제한주식 2건으로 구성되었습니다.
스톡 옵션은 각각 2021년 9월 1일 Iveric Bio의 보통주의 종가와 동일한 주당 $10.45의 행사 가격을 가지고 있습니다. 스톡 옵션은 각각 10년의 기간과 4년 동안 가득되며 25%의 2022년 9월 1일에 가득된 각 옵션의 기초가 되는 주식과 그 이후 매월 말에 가득되는 각 옵션의 기초가 되는 주식의 추가 2.0833%. 회사 보통주의 주식에 대한 제한된 주식 단위의 두 부여는 각각 2022년 9월 1일 부여의 기초 주식의 100%에 대해 가득됩니다. 각 부여의 가득은 다음을 통해 회사에 대한 직원의 지속적인 근무에 따라 결정됩니다. 적용 가능한 가득 날짜.
이베릭 바이오
Iveric Bio는 상당한 미충족 의학적 요구가 있는 망막 질환에 대한 새로운 치료 옵션의 발견 및 개발에 중점을 둔 과학 기반 바이오 제약 회사입니다. 회사는 현재 노인성 망막질환 치료제 후보물질과 희귀 유전성 망막질환 치료제 후보물질을 모두 개발하고 있다.
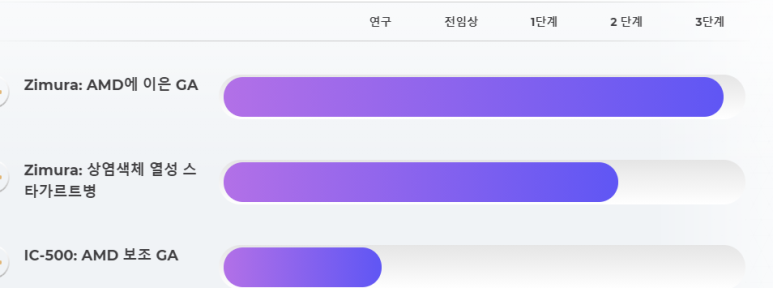
파이프라인
치료학
AAV 유전자 요법

경영진


2021년 2분기 재무자료 운영 하이라이트 및 재무 결과
2021년 4월 8일
- GATHER2 3 단계 Zimura의 임상 시험에 대한 수신 FDA 계약에 따라 특수 프로토콜 평가 (SPA) ® 연령 관련 황반 변성에 지리적 위축 차에서 -
- Zimura GATHER2 등록 완료; 90% 이상의 주입 충실도 비율 목표로 기대치를 초과하는 유지 -
- GATHER1 18개월 사후 분석은 Zimura 2mg이 지리적 위축 이전의 건성 AMD의 초기 단계에 영향을 미칠 가능성이 있음을 보여줍니다 -
- 오늘 회의 및 웹캐스트, 2021년 8월 4일, 에 동부 표준시 오전 8시 -
뉴욕--(비즈니스 와이어)--8월. 2021년 4월 4일 -- (주)이베릭바이오 (나스닥: ISEE)가 마감된 분기의 재무 및 운영 결과를 오늘 발표했습니다. 2021년 6월 30일 일반적인 비즈니스 업데이트를 제공했습니다.
"특히 Zimura 중추 프로그램의 실행과 관련하여 몇 가지 혁신적인 이정표를 달성했기 때문에 지금은 회사에 흥미로운 시기입니다."라고 말했습니다. 글렌 P. 스블렌도리오, 최고 경영자 이베릭 바이오. “연령 관련 황반변성으로 인한 지리학적 위축에 대한 두 번째 Zimura 임상 3상 임상 시험인 GATHER2의 경우 FDA로부터 특별 프로토콜 평가 계약을 받았고 예정보다 4개월 앞서 등록을 완료했으며 주입 충실도 비율은 계속해서 기대치를 초과했으며 우리는 12개월 비율을 90% 이상으로 목표로 삼고 있습니다. 또한 AMD에 이은 GA에 대한 첫 Zimura 3상 임상 시험인 GATHER1의 사후 분석 결과에 따르면 Zimura가 GA의 초기 단계에서 치료적 이점을 가질 수 있음을 나타냅니다.”
"우리는 우리가 만든 모멘텀을 매우 자랑스럽게 생각합니다. 이베릭 바이오. "동안2021년 7월, 우리는 공모로 대차 대조표를 강화했습니다. 우리는 이것이 우리가 Zimura GATHER2 3상 시험에서 탁월한 유지로 인상적인 채용을 더욱 지원하고 AMD에 이차적으로 GA에서 Zimura에 대한 신약 신청을 준비하고 잠재적으로 제출할 수 있게 하며 GA에서 Zimura의 잠재적인 상업적 출시를 위한 준비를 시작할 수 있다고 믿습니다 AMD에 drusen 임상 개발 프로그램을 시작하고 Zimura를 위한 지속 방출 전달 기술에 투자합니다. 우리는 Zimura, HtrA1 억제제 및 유전자 요법 프로그램을 통해 망막 질환 치료제를 개발하고 제공하기 위한 전략을 실행하기 위해 최선을 다하고 있으며 장기적 주주 가치를 창출할 가능성이 있습니다.”
연령 관련 황반 변성(AMD)에 대한 이차적 지리 위축(GA)을 대상으로 하는 치료 프로그램
Zimura ® (avacincaptad pegol): 보완 C5 억제제
GATHER2를 위한 특별 프로토콜 평가(SPA)
회사 발표2021년 7월 6일,로부터 서면 동의를 받았다. 미국 식품의약국(FDA)는 AMD에 이차적인 GA 치료를 위해 개발 중인 Zimura의 두 번째 중추 임상 시험인 GATHER2의 전체 디자인에 대한 특별 프로토콜 평가(SPA) 하에 있습니다. 이 계약은 진행 중인 GATHER2 임상 시험이 12개월에 1차 평가변수를 충족하는 경우 AMD에 이차적인 GA용 Zimura의 마케팅 승인을 위해 FDA에 신청서를 제출하려는 회사의 계획을 더욱 공고히 합니다. Zimura는 12개월에 사전 지정된 1차 유효성 평가변수를 충족했으며 이전에 완료된 GATHER1 중추 임상 시험에서 통계적 유의성에 도달했습니다.
GATHER2 SPA에 대한 논의와 병행하여 FDA는 Zimura에 대한 향후 NDA 제출의 일환으로 GATHER1 결과가 사후 분석과 함께 사전에 지정된 원래의 1차 효능 평가변수 분석을 사용하여 고려될 것이라고 회사에 밝혔습니다. GATHER2 시험(관련 시점에서 안저 자가형광(FAF)에 의해 측정된 GA 면적을 기반으로 추정된 평균 성장률(기울기))에 사용될 동일한 FDA 선호 방법을 사용합니다. FDA 우선 분석에 의해 분석된 GATHER 1 결과는 사전에 지정된 원래 분석의 결과와 매우 일치하며 이를 강력하게 지지합니다. GATHER1에 대한 두 분석의 완전한 결과는 회사의2021년 7월 6일 보도 자료 및 양식 8-K 제출.
GATHER2 등록, 유지 및 주입 충실도
켜기2021년 7월 26일, 회사는 회사의 원래 일정보다 4개월 앞서 GATHER2의 등록 완료를 발표했습니다. 이 타임라인을 기반으로 회사는 최종 환자 등록 후 약 1년 후인 2022년 하반기에 데이터베이스 잠금 및 분석에 필요한 시간을 더한 GATHER2 탑라인 데이터를 사용할 수 있을 것으로 예상합니다.
2021년 6월, 회사는 12개월 동안 주사 충실도 비율로 측정한 GATHER2 시험의 환자 유지율이 90% 이상을 목표로 한다고 발표했습니다. 주입 충실도 비율은 회사의 기대치를 계속 초과합니다. 주입 충실도는 등록된 환자 수를 기준으로 실제 총 주입 횟수를 예상 총 주입 횟수로 나누어 계산합니다. 회사는 환자의 눈에 적시에 약물을 투여하는 것을 반영하기 때문에 주입 충실도를 환자 유지의 가장 중요하고 엄격한 측정으로 간주합니다.
지리적 위축에 드라이 AMD의 초기 단계 이전
에2021년 6월, Vas Sadda, MD, 도헤니 안과 연구소 ~에 UCLA은 가짜 그룹의 환자와 비교하여 Zimura 2mg으로 치료받은 환자에서 건성 AMD의 초기 형태인 드루젠 및 초기 GA(iRORA/cRORA)의 진행에 대한 GATHER1 시험의 새로운 사후 분석을 발표했습니다. 이러한 사후 분석은 Zimura가 위축이 발생하기 전에도 AMD에 영향을 미쳐 질병의 자연적 경과를 변화시킬 가능성이 있음을 시사합니다. 회사는 2022년에 드루젠 임상 개발 프로그램을 시작할 것으로 기대하고 있습니다.
상염색체 열성 스타가르트병
STAR 시험이라고 하는 상염색체 열성 스타가르트병 치료를 위한 Zimura의 2b상 스크리닝 임상 시험에 환자 등록은 총 약 120명의 환자에 대해 약 25명의 새로운 환자를 등록하는 것을 목표로 진행 중입니다.
IC-500: HtrA1(고온 요구 사항 A 세린 펩티다제 1 단백질) 억제제
2021년 2분기 동안 회사는 IC-500에 대한 첫 번째 전임상 내약성 연구를 시작했으며 현재 약동학 및 표적 참여 연구를 포함한 추가 전임상 연구를 계획하고 있습니다. 제형 최적화 및 기타 제조 활동도 진행 중입니다. 회사는 2022년 하반기에 AMD에 이어 GA에서 IC-500에 대한 연구용 신약 신청(IND)을 FDA에 제출할 예정입니다.
희귀 유전성 망막 질환(IRD)의 유전자 치료 프로그램
IC-200: BEST1 관련 IRD
회사는 Best disease의 자연 발생 개 질병 모델에서 IC-200의 IND 가능 전임상 독성 연구를 완료했습니다. 규제 검토에 따라 회사는 2021년 4분기에 IC-200의 1/2상 임상 시험을 시작할 계획입니다. 첫 번째 IC-200 임상 시험은 질병의 상염색체 열성 형태인 상염색체 열성 환자에 초점을 맞출 것입니다. 베스트로핀 병증.
IC-100: Rhodopsin-Mediated Autosomal Dominant Retinitis Pigmentosa (RHO-adRP)
이전에 공개된 바와 같이, 회사는 IC-100에 대한 독성 연구 결과 및 최초의 인간 IND를 제출하기 전에 임상 시험. FDA는 이번 회의 대신 IND 제출 후 30일 간의 IND 검토 기간 동안 추가 논의가 이루어져야 한다고 조언했다. 회사는 현재 이 제품 후보에 대한 개발 옵션을 고려하고 있습니다.
Minigene Programs
The Company는 minigene과의 협력을 통해매사추세츠 의과 대학(UMMS)는 Leber Congenital Amaurosis Type 10(LCA10) miniCEP290 프로그램의 주요 구성을 확인했으며 현재 이 프로그램에 대한 전임상 개발을 계획하고 있습니다. 회사는 Stargardt Disease(ABCA4) 프로그램의 전임상 데이터를 평가하고 있으며 2022년 상반기에 USH2A 관련 유전성 망막 질환(USH2A) 프로그램의 예비 결과를 얻을 것으로 예상합니다.
회사는 최근 이전에 UMMS에 있었던 4명의 개인을 고용했습니다. , 포함헤만트 칸나, Ph.D., 회사의 miniCEP290, miniABCA4 및 miniUSH2A 후원 연구 프로그램의 수석 연구원. 칸나 박사 부사장으로 회사에 합류, 전임상 안구 연구. 회사는 이러한 프로그램에 대한 연구 및 전임상 개발 활동을 UMMS에서 회사로 이전하기 위해 노력하고 있습니다. 회사는 또한 이 직원들이 회사를 위한 이러한 프로그램 및 기타 전임상 연구 및 개발 활동을 계속할 수 있도록 실험실 공간을 마련할 준비를 하고 있습니다.
관리 업데이트
에 2021년 8월, 크리스토퍼 심스 합류 이베릭 바이오 수석 부사장 겸 최고 상업 책임자. 심즈 씨 Johnson & Johnson에서 20년 이상의 다양한 상업 리더십 경험을 가진 뛰어난 의료 리더입니다. 제넨텍, 망막, 안과 및 검안 분야의 집중 경험을 포함한
2분기 재무 실적 및 2021년 현금 지침
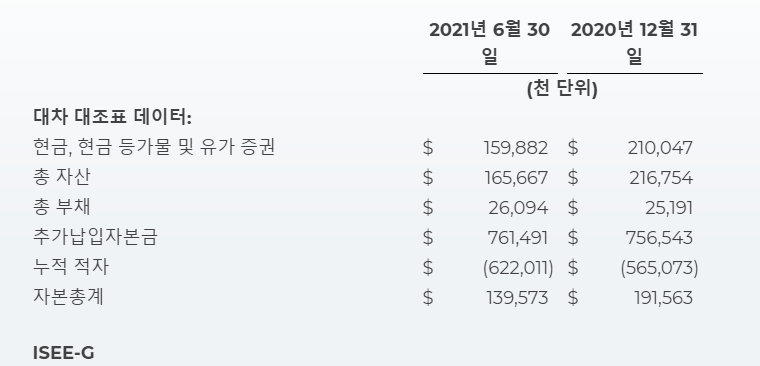
현재 2021년 6월 30일, 회사는 1억 5,990만 달러 현금 및 현금 등가물로.
에 2021년 7월, 회사는 약 1억 800만 달러인수된 보통주의 공모의 순수익금. 회사는 이번 공모에서 보통주 13,397,500주를 매각했습니다.
회사는 현재 2021년 말 현금, 현금 등가물 및 매도가능 증권을 2억 1500만 달러 그리고 2억 2,500만 달러. 회사는 또한 현금, 현금 등가물 및 매도가능 증권이 최소 2024년 중반까지 계획된 자본 지출 요건 및 운영 비용을 충당하기에 충분할 것으로 추정합니다. 이러한 추정은 Zimura에 대한 진행 중인 임상 개발 프로그램, AMD에 이은 GA에서 Zimura에 대한 신약 신청 및 마케팅 승인 신청서의 준비 및 잠재적 제출, AMD에 이어 GA에서 Zimura의 잠재적 상업적 출시 준비 시작, drusen 임상 개발 시작 프로그램, Zimura의 서방형 전달 기술에 대한 투자, IC-200 및 IC-100 프로그램을 클리닉으로 진행, IC-500 개발 프로그램의 발전.(주)아케믹스 및 Zimura의 실제 상업적 출시에 대한 잠재적 비용, GA 및 drusen 외부의 적응증에서 잠재적으로 Zimura를 연구하는 것과 관련된 추가 지출 또는 추가 제품 후보 또는 기술의 잠재적인 라이선스 또는 인수로 인해 발생하는 추가 지출, 회사가 추구할 수 있는 관련 개발 .
2021년 2분기 재무 하이라이트
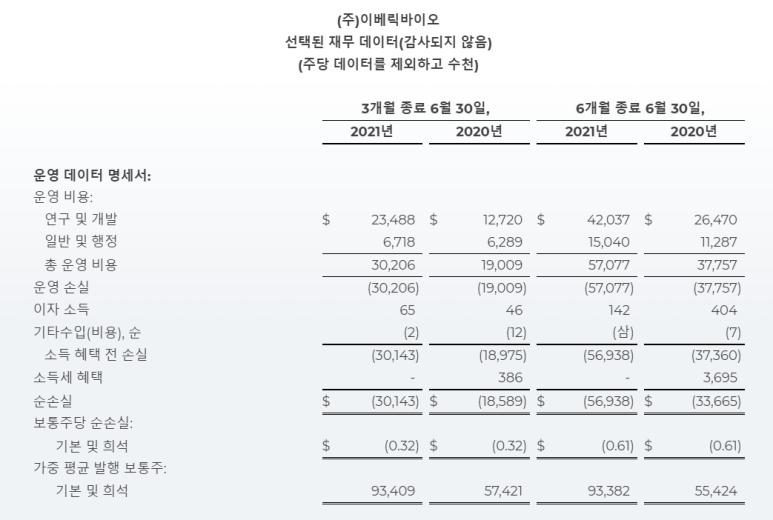
연구개발비 : 연구개발비2,350만 달러 분기 종료 2021년 6월 30일, 에 비해 1270만 달러 2020년 같은 기간 동안. 종료된 6개월 동안 2021년 6월 30일, 연구 개발 비용은 4200만 달러 에 비해 2,650만 달러 연구 개발 비용은 주로 환자 등록 시작 및 GATHER2 임상 시험의 지속적인 진행, Zimura의 제조 활동 증가 및 연구 개발 인력 증가로 인해 증가했습니다.
관리비 : 일반관리비670만 달러 분기 종료 2021년 6월 30일, 에 비해 630만 달러 2020년 같은 기간 동안. 종료된 6개월 동안 2021년 6월 30일, 일반 및 관리 비용은 1,500만 달러 에 비해 1130만 달러 일반 및 관리 비용은 주로 지속적인 소송 노력과 관련된 법률 비용으로 인해 증가했습니다.
법인세 혜택 : 회사는 종료 3개월 및 6개월 동안 법인세 혜택이 없습니다.2021년 6월 30일. 소득세 혜택40만 달러 그리고 370만 달러 3개월 6개월 동안 2020년 6월 30일, 각각은 주 법인 소득세 감사의 유리한 결산을 반영하는 것으로 인식되었습니다.
순손실 : 회사는 마감된 분기의 순손실을 보고했습니다.2021년 6월 30일 NS 3010만 달러, 또는 ($0.32) 순손실 대비 희석주당 1,860만 달러, 또는 $(0.32) 2020년 같은 기간 동안 희석주당. 종료 6개월 동안 2021년 6월 30일, 회사는 의 순손실을 보고했습니다. 5,690만 달러 또는 ($0.61) 순손실 대비 희석주당 3,370만 달러 또는 ($0.61) 2020년 같은 기간 동안.
기업 프레젠테이션 자료
https://investors.ivericbio.com/static-files/7c5f0876-e84b-44a6-9534-928070c4424b
'미국주식' 카테고리의 다른 글
| [미국 주식] Paltalk, Inc. (PALT,팔토크) (0) | 2021.09.27 |
|---|---|
| [미국 주식]Cellect Biotechnology Ltd. (APOP) 주가가 급등한 이유는? (0) | 2021.09.27 |
| [미국 주식] T2 Biosystems, Inc.(TTOO) 주가가 급등한 이유는? (0) | 2021.09.11 |
| [미국 주식]Echo Global Logistics, Inc. (ECHO,에코 글로벌 로지스틱스) 주가가 급등한 이유는? (0) | 2021.09.11 |
| [미국 주식]Endo International plc (ENDP,엔도 인터내셔널) 주가가 급등한 이유는? (0) | 2021.09.11 |



댓글