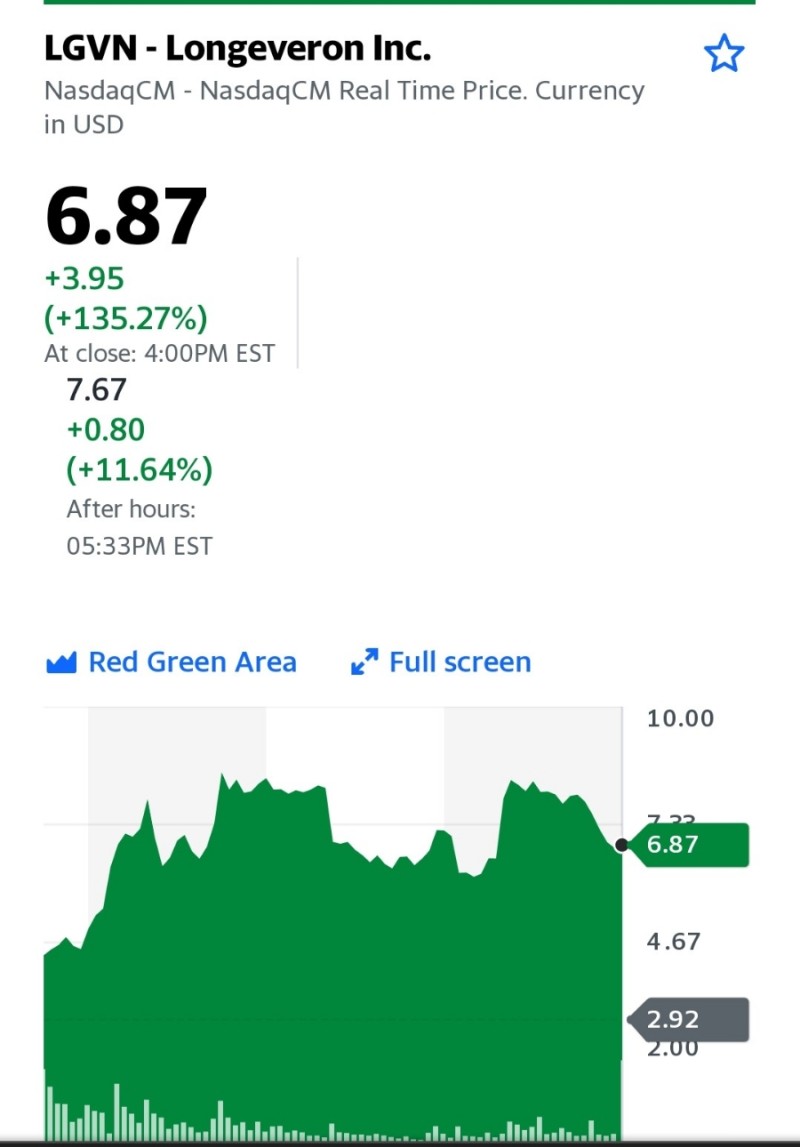
미국 식품의약국(FDA), 생명을 위협하는 유아 심장 상태를 치료하기 위한 희귀 소아 질환 지정에 대해 Longeveron의 Lomecel-B 승인
롱베론
2021년 11월 18일 목요일 오후 9시·
연간 약 1,000명의 아기에게 영향을 미치는 저형성 좌심장 증후군에 대한 임상 2상 시험 진행 중
마이애미, Nov. 18, 2021 (GLOBE NEWSWIRE) -- Longeveron Inc.(NASDAQ: LGVN)("Longeveron" 또는 "회사"), 만성 노화 관련 및 생명을 위협하는 상태에 대한 세포 치료제를 개발하는 임상 단계 생명공학 회사, 미국 식품의약국(FDA)은 희귀하고 생명을 위협하는 영유아의 선천성 심장 결함인 HLHS(저형성 좌심장 증후군) 치료에 로메셀-B를 희귀 소아과 질환(RPD)으로 지정했다고 오늘 발표했다. 연구 동종 골수 유래 의약 신호 세포(MSC) 제품인 Lomecel-B는 현재 2상 시험에서 평가되고 있습니다.
Longeveron의 공동 설립자이자 최고 과학 책임자인 조슈아 M. 헤어(Joshua M. Hare) 박사는 “이 희귀하고 파괴적인 선천성 심장 결함을 갖고 태어난 아이들을 위한 안전하고 효과적인 치료가 시급하다는 FDA의 승인을 기쁘게 생각합니다.”라고 말했습니다. 우리의 1상 임상 데이터와 진행 중인 2상 시험의 진행 상황. Lomecel-B는 이러한 심각한 영향을 받은 영아에게 수술과 동시에 시행할 수 있는 독특한 세포 치료 접근법을 나타냅니다.”
미국에서 매년 약 1,000명의 아기가 HLHS를 갖고 태어납니다. HLHS는 종종 외과적 개입 없이 치명적이며, 우심실이 신체에 혈액을 펌핑하도록 구성될 수 있도록 약 5년의 기간에 걸쳐 세 번의 수술 절차가 수행됩니다. Longeveron은 두 번째 수술(4~6개월) 동안 우심실에 Lomecel-B 주사의 안전성과 심장 기능 및 기타 건강 상태 평가변수에 대한 영향을 평가하고 있습니다.
Longeveron은 최근 HLHS 환자를 대상으로 한 Lomecel-B의 안전성에 중점을 둔 1상 임상 연구의 임상 결과를 보고했습니다. 심장 외과 의사가 수술 당시 아기의 심장에 직접 Lomecel-B를 주입했을 때, 세포는 주요 심장 부작용 없이 잘 견디었고 연구 치료와 관련된 것으로 간주되는 감염도 없었습니다.
1상 시험에 등록된 영아의 100%(n=10)가 생존했으며 수술 후 2~3.5년 사이에 이식이 필요하지 않았습니다. 체중 증가 및 성장 패턴과 같은 아기의 건강에 대한 다른 측정값은 정상적인 건강한 아기의 측정값과 일치했습니다.
FDA는 주로 미국에서 18세 이하의 어린이와 200,000명 미만의 개인에게 영향을 미치는 질병에 대해 RPD 지정을 부여할 수 있습니다. 이 프로그램에 따라 FDA가 Lomecel-B를 HLHS 치료에 승인하면 Longeveron은 제품에 대해 제출된 신청서가 특정 조건을 충족하고 현행법에 따라 2026년 9월 30일 이전에 승인된 경우 우선 심사 바우처(PRV) 표준 10개월과 달리 6개월 만에 출시하여 잠재적으로 출시 시간을 단축하거나 PRV를 다른 회사에 판매할 수 있습니다. PRV 신속 검토는 잠재적으로 생명을 구하거나 변화시키는 치료에 더 빨리 접근할 수 있는 심각한 상태의 환자를 위한 것입니다. 기업의 경우,
HLHS가 있는 유아는 현재 38명을 대상으로 하는 2상 무작위 이중 맹검 대조 임상 시험인 ELPIS II에 등록하고 있습니다. ELPIS II는 Longeveron과 협력하여 국립 보건원의 국립 심장, 폐, 혈액 연구소(NHLBI, 보조금 번호 1UG3HL148318)의 보조금으로 일부 자금을 지원받고 있으며 수석 연구원 Sunjay Kaushal, MD, PhD, 시카고의 Ann 및 Robert H. Lurie 아동 병원 심혈관 흉부 외과 부문장. 현재 등록을 위해 열려 있는 다른 참여 임상 사이트는 일리노이주 파크 릿지(Park Ridge)에 있는 Advocate Children's Hospital입니다. 초등학교 아동 병원/유타 대학교, 솔트레이크시티, 유타; 캘리포니아 로스앤젤레스 아동 병원 로스앤젤레스; 및 Cincinnati Children's Hospital Medical Center, Cincinnati, OH.
회서 소개
Longeveron은 특정 노화 관련 및 생명을 위협하는 상태에 대한 세포 요법을 개발하는 임상 단계의 생명공학 회사입니다. 회사의 주요 연구 제품은 젊고 건강한 성인 기증자의 골수에서 채취한배양 확장 의약 신호 세포(MSC)에서 파생된 LOMECEL-B™ 세포 기반 치료 제품("Lomecel-B")입니다. Longeveron은 조직 복구, 장기 유지 및 면역 체계 기능을 촉진하는 동일한 세포를 사용함으로써 노화 과정 및 기타 의학적 장애와 관련된 가장 어려운 장애에 대한 안전하고 효과적인 치료법을 개발할 수 있다고 믿습니다. Longeveron은 현재 다음 적응증에 대한 1상 및 2상 임상 시험을 후원하고 있습니다. 노화 노쇠, 알츠하이머병, 대사 증후군, 급성 호흡 곤란 증후군(ARDS), 및 저형성 좌심장 증후군(HLHS). 회사의 사명은 규제 승인, 후속 상업화 및 의료계의 광범위한 사용을 목표로 Lomecel-B 및 기타 세포 기반 제품 후보를 중추적인 3상 시험으로 발전시키는 것입니다.
https://finance.yahoo.com/news/u-food-drug-administration-approves-130000821.html
'미국주식' 카테고리의 다른 글
| [미국 주식 ] iSpecimen Inc(ISPC, 아이스페시맨) (0) | 2021.11.23 |
|---|---|
| [미국 주식] Vonage Holdings Corp(VG, 보니지 홀딩스) 주가가 급등한 이유는? (0) | 2021.11.23 |
| [미국 주식] Snow Lake Resources Ltd. Common Shares (LITM, 스노우 레이크 리소스) 주가가 급등한 이유는? (0) | 2021.11.20 |
| [미국 주식]Patriot National Bancorp, Inc. (PNBK) 주가가 급등한 이유는? (0) | 2021.11.16 |
| [미국 주식]EyePoint Pharmaceuticals, Inc. (EYPT,아이포인트 파머슈티컬스) 주가가 급등한 이유는? (0) | 2021.11.15 |




댓글