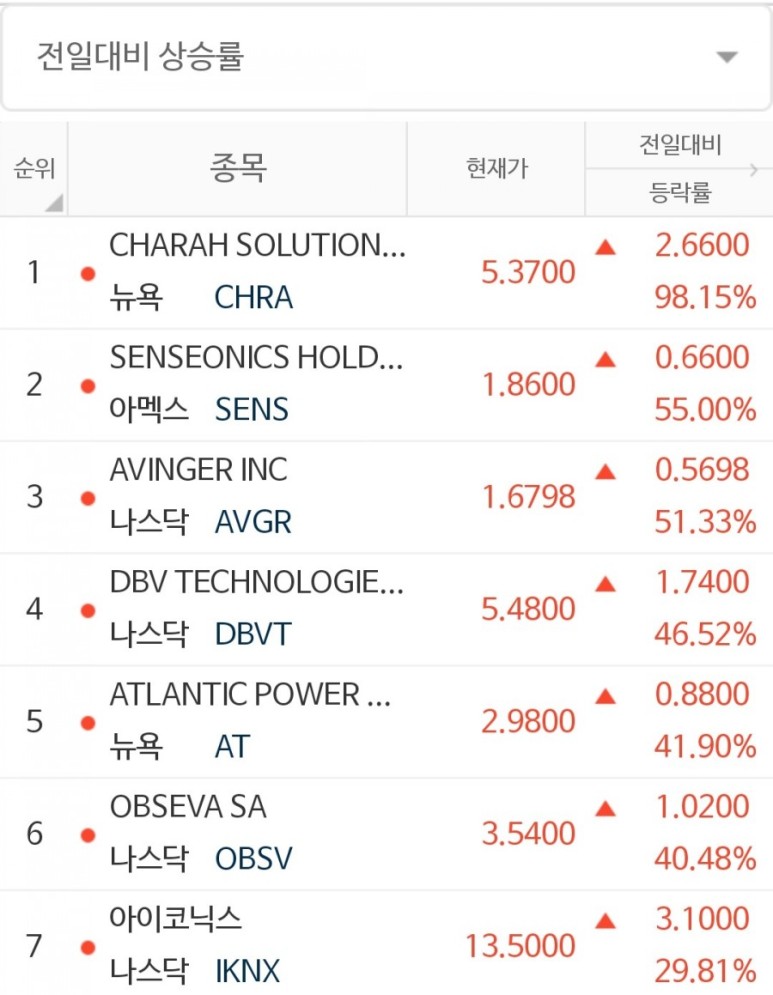
안녕하세요. 옆집 세라입니다. 오늘의 전일대비 상승율 6위는 Obseva SA가 되겠습니다. 변덕스러운 랭킹이지만 하나씩 알아나가봅시다 :) 미국 동전주 마스터가 되는 그날까지 ♥
기업 소개
여성 생식기 관련 바이오 제약회사
2012 년 11 월에 설립 된 ObsEva는 여성의 생식 건강과 임신을 개선하기위한 새로운 치료법을 개발하고 상업화하는 바이오 제약 회사입니다. ObsEva는 전략적 인 라이센스 및 규율 된 약물 개발을 통해 자궁 내막증, 자궁 근종 및 조산 치료에 초점을 맞춘 개발 프로그램을 갖춘 후기 임상 파이프 라인을 구축했습니다. ObsEva는 나스닥 글로벌 셀렉트 마켓에 상장되어 있으며“OBSV”시세 기호로 거래되고 있으며, 시세 기호“OBSN”으로 거래되고있는 SIX 스위스 거래소에서 거래되고 있습니다. 자
주식이 급등한 이유는?
Yselty® (Linzagolix) 임상 개발 프로그램에 대한 업데이트 제공했기 때문
2021 년 1 월 11 일
– European Medicines Agency는 자궁 섬유종에 대한 Yselty MAA를 검증합니다. 2021 년 상반기 미국 NDA 계획
– 3 상 EDELWEISS 3 (유럽 및 미국에서 실시) 자궁 내막증 치료를위한 Yselty 연구가 계획대로 진행 중입니다. 1 차 엔드 포인트 판독 값은 2021 년 4 분기에 예상됩니다.
– 3 상 EDELWEISS 2 (미국에서 실시) 등록 문제로 인해 Yselty 자궁 내막증 연구 중단; 확인 된 안전 문제 없음
스위스 제네바와 매사추세츠 주 보스턴 (2021 년 1 월 11 일) – 여성의 생식 건강을 개선하기 위해 새로운 치료법을 개발하고 상업화하는 바이오 제약 회사 인 ObsEva SA (NASDAQ : OBSV; SIX : OBSN) 는 오늘 Yselty 프로그램에 대한 몇 가지 중요한 업데이트를 발표했습니다.
자궁 근종 치료를위한 마케팅 승인 신청 검증
마케팅 승인 신청서 (MAA)는 유럽 의약품 국 (EMA)에 제출 된 승인 신청서이며 EU에서 제품을 마케팅하는 데 중요한 단계입니다. 유효성 검사는 검토 기간의 시작을 표시합니다. 자궁 근종 적응증에 대한 Yselty MAA는 3 상 PRIMROSE 1 연구 (미국에서 수행, 자궁 근종이있는 여성 574 명 등록) 및 PRIMROSE 2 (유럽 및 미국에서 수행, 여성 535 명 등록)의 데이터를 기반으로합니다. 자궁 근종). 두 연구 모두에서 자궁 섬유종과 관련된 과다한 월경 출혈 (HMB) 환자에게 호르몬 추가 요법 (ABT, 1mg 에스트라 디올 /0.5mg 노르에 티스 테론 아세테이트)을 포함하거나 포함하지 않고 100mg 또는 200mg의 Yselty 용량을 투여했습니다. 위약.
ObsEva의 최고 의료 책임자 인 Elizabeth Garner, MD, MPH는 "EMA가 자궁 섬유종과 관련된 과도한 월경 출혈로 고통받는 여성을위한 잠재적 인 동급 최강의 치료법 인 Yselty에 대한 우리의 신청을 검증 한 것을 매우 기쁘게 생각합니다."라고 말했습니다. “Yselty는 유연한 투여 옵션을 제공하는 유일한 GnRH 길항제로서 자궁 섬유종이있는 다양한 여성 집단의 개별 요구 사항을 더 잘 해결할 수 있습니다. 이는 Yselty를 EU에서 사용할 수있게하는 데 중요한 이정표이며, Yselty를 상용화로 발전시키는 과정에서 EMA와 긴밀히 협력하기를 기대합니다. 우리는 또한 올해 회사의 핵심 목표 인 2021 년 상반기 동안 미국 NDA를 제출할 계획을 유지하고 있습니다.”
PRIMROSE 1과 2는 모든 용량이 위약에 비해 통계적으로 유의하고 임상 적으로 관련된 HMB 감소를 보여 주면서 1 차 평가 변수를 성공적으로 충족했습니다. ABT 용량으로 200mg을 투여받은 여성에서 관찰 된 1 차 평가 변수에 대한 가장 높은 반응자 비율과 함께 명확한 효능 용량 반응이있었습니다. 저용량 100mg 비 ABT 요법에서도 매우 유의 한 효능이 달성되었습니다. 또한 무월경의 2 차 평가 변수, 월경 출혈 감소 시간, 빈혈 피험자의 헤모글로빈 수치, 통증 및 삶의 질에 대한 모든 용량에서 상당한 개선이 관찰되었습니다.
ObsEva는 2021 년 1 분기에 후속 데이터 및 6 개월 치료 후 평가 데이터를 예상 합니다 . 이 연구에 대한 추가 정보는 여기 에서 찾을 수 있습니다 .
자궁 내막증 관련 통증 치료를위한 임상 개발 프로그램
자궁 내막증 적응증을위한 임상 개발 프로그램은 ObsEva의 핵심 우선 순위입니다. EU의 EDELWEISS 3 임상 시험은 계획대로 진행되고 있으며, 1 차 평가 변수 데이터는 2021 년 4 분기에 예상됩니다. 미국에서 EDELWEISS 2에 대한 선별 및 등록은 특히 진행중인 유행병의 지속적인 어려운 환경의 맥락에서 점점 더 어려워지고 있습니다. ObsEva는 연구를 중단하기로 결정했습니다. 새롭거나 중요한 안전 문제는 관찰되지 않았습니다.
“우리는 신중한 고려 끝에 EDELWEISS 2 연구를 중단하는 것이 지속적인 등록 문제를 고려할 때 ObsEva에게 올바른 결정이라고 강력하게 믿습니다. 이 결정은 또한 우리에게 3 천만 달러 이상을 절약 할 수있는 능력을 제공합니다.”라고 ObsEva의 CEO 인 Brian O'Callaghan이 말했습니다. 우리는 자궁 섬유종과 자궁 내막증 모두에서 Yselty를 개발하고 상업화하는 데 전념하고 있으며 프로그램을 지원하기위한 파트너십 및 기타 자금 조달 기회를 계속 모색하고 있습니다. 우리는 또한이 중요한 적응증에 대한 원래의 MAA 및 NDA 제출 일정을 유지하기 위해 가능한 한 빨리 새로운 3 상 자궁 내막증 연구를 수행 할 계획입니다. 또한이 비용 효율적인 접근 방식은 ObsEva가 ebopiprant, 최근에 양성 2 상 결과를 보인 결과 조산 치료가 시작되었습니다. 우리는 또한 안드로겐 박탈 요법의 부작용을 낮추기위한 알려진 접근법 인 에스트로겐 애드 백과 결합하여 전립선 암에서 linzagolix의 잠재적 인 개발을 고려하고 계획하고 있습니다. 전반적으로, 자본 활용을 개선하면서 자궁 내막증 적응증 개발의 개발을보다 효율적으로 완료하려는 우리의 전략은 우리의 임상 개발 전략을 지원하고 여성의 생식 건강에 대한 충족되지 않은 요구를 해결하는 데 한 걸음 더 다가 갈 것입니다. 안드로겐 박탈 요법의 부작용을 낮추는 알려진 접근법. 전반적으로, 자본 활용을 개선하면서 자궁 내막증 적응증 개발의 개발을보다 효율적으로 완료하려는 우리의 전략은 우리의 임상 개발 전략을 지원하고 여성의 생식 건강에 대한 충족되지 않은 요구를 해결하는 데 한 걸음 더 다가 갈 것입니다. 안드로겐 박탈 요법의 부작용을 낮추는 알려진 접근법. 전반적으로, 자본 활용을 개선하면서 자궁 내막증 적응증 개발의 개발을보다 효율적으로 완료하려는 우리의 전략은 우리의 임상 개발 전략을 지원하고 여성의 생식 건강에 대한 충족되지 않은 요구를 해결하는 데 한 걸음 더 다가 갈 것입니다.
진행중인 3 상 EDELWEISS 3 연구는 월경통 (월경통)과 비 월경 골반통 모두에 대한 반응의 공동 1 차 종점과 함께 자궁 내막증 관련 통증을 가진 약 450 명의 환자를 등록 할 것입니다. 이 연구에는 호르몬 ABT없이 1 일 1 회 75mg, 호르몬 ABT (1mg E2 / 0.5mg NETA)와 함께 1 일 1 회 200mg이 포함됩니다. 초기 6 개월 치료 기간을 완료 한 피험자는 6 개월 치료 연장을 선택할 수 있습니다. 1 차 평가 변수의 데이터는 2021 년 4 분기에 예상됩니다.이 연구에 대한 추가 정보는 여기에서 확인할 수 있습니다 .
Yselty® 정보
Yselty® (이전에 OBE2109로 알려진 린 자골 릭스)는 잠재적으로 동급 최고의 프로필을 가진 새로운 경구 용 GnRH 수용체 길항제입니다. Yselty는 현재 자궁 섬유종과 관련된 과다한 월경 출혈 및 자궁 내막증과 관련된 통증 치료를위한 후기 임상 개발 단계에 있습니다. ObsEva는 2015 년 말에 Kissei로부터 Yselty 라이선스를 취득했으며 제품에 대해 아시아를 제외한 전 세계 상업적 권리를 보유하고 있습니다.
Yselty®는 ObsEva에서 사용하기 위해 Kissei가 소유 한 등록 상표입니다. Yselty®는 아직 전 세계 어디에서나 사용하도록 승인되지 않았습니다.
https://www.obseva.com/pressrelease-detail/?pr=3856
pressrelease detail - ObsEva
Press releases ObsEva Provides Update on Yselty® (Linzagolix) Clinical Development Program January 11, 2021 – European Medicines Agency Validates Yselty MAA for Uterine Fibroids; US NDA Planned for 1H 2021 – Phase 3 EDELWEISS 3 (Conducted in Europe and US) Study of Yselty for Treatment of Endometrio...
www.obseva.com
파이프라인
1.Nolasiban (OBE001) — 보조 생식 기술
ObsEva는 현재 수축을 감소시키고, 자궁 혈류를 개선하며, 배아 이식에 대한 자궁 내막의 수용력을 향상시킬 수있는 경구 용 옥시토신 수용체 길항제 인 놀라 시반 ( OBE001 )을 발전시키고 있습니다. 이것은 ART 이후 배아 이식을받는 환자들 사이에서 성공적인 임신과 출산의 기회를 증가시킵니다.
2 상 용량 범위 임플란트 1 임상 시험 (n = 247)은 신선한, 3 일, 단일 또는 이중 배아 이식 전 약 4 시간 전에 놀라 시반의 단일 경구 900mg 용량이 진행중인 임신 및 생계에서 가장 높은 증가를 보였습니다. 저용량 100mg 및 300mg 및 위약 대비 출생률.
EU 중추적 단계 시험 IMPLANT 2는 IVF 후 SET 전에 투여 된 놀라 시반의 단일 경구 용량 (900mg)을 평가하는 다국적, 이중 맹검, 무작위, 병렬 그룹, 위약 대조 시험이었습니다. 난 모세포 채취 후 3 일 (D3) 또는 5 일 (D5)에 단일 양질의 배아를 옮겼습니다. D3 또는 D5 로의 이전 결정은 치료를 연구하기 위해 무작위 화하기 전에 각 환자에 대해 임상 적으로 이루어졌습니다. D3 또는 D5에 ET를받은 동일한 수의 환자가 모집되었습니다. 이 실험은 9 개 유럽 국가의 41 개 불임 센터에서 수행되었습니다.
3 단계 임플란트 2는 1 차 엔드 포인트를 충족했습니다. 통합 된 D3 / D5 ET 집단의 지속적인 임신 률은 위약군에서 28.5 %, 놀라시 반군에서 35.6 %였습니다 (p = 0.031). 가장 큰 영향은 D5 ET 그룹에서 관찰되었습니다. 놀라 시반 투여군 45.9 %에 비해 위약군 34.7 % (p = 0.034). 살아있는 출산율은 D3 / D5 합동에서 27.7 %와 34.8 % (p = 0.025), D5 ET 후 33.2 %와 44.8 % (p = 0.025)였으며, 위약과 놀라 시반이 각각 있었다. 놀라 시반은 위약과 유사한 안전성 프로파일로 잘 견뎌냈습니다. 새로운 SET 이전에 투여 된 놀라 시반의 단일 경구 투여는 위약에 비해 지속적인 임신 및 출생률을 현저하게 증가 시켰습니다. nolasiban의 사용은 IVF에서 배아 이식 후 임신 및 출생률을 증가시킬 수 있습니다. 산모와 산과 결과는 치료 그룹간에 매우 유사했습니다.
특히 D5 ET 그룹에서 지속적인 임신과 출생률을 개선하는 nolasiban의 이러한 능력은 nolasiban이 ET 후 IVF 효능을 증가시킬 가능성이 있음을 나타내므로 아기를 낳는 데 필요한 IVF주기의 수를 줄일 수 있습니다. 또한, 단일 배아로 유리한 결과는 SET의 사용을 증가시켜 다태 출산의 발생률을 줄이는 데 도움이 될 수 있습니다.
2019 년 11 월 7 일, 우리는 임플란트 4 임상 시험이 10 주에 진행중인 임신 률 증가의 1 차 평가 변수를 충족하지 못했다고 발표했습니다 (위약 39.1 % vs 놀라 시반 40.5 %) (p = 0.745). 이러한 결과가 이전의 긍정적 인 임상 3 상 임플란트 2 임상 결과를 확인하지 않았기 때문에, 우리는 IVF에 대한 nolasiban의 현재 개발을 중단하고 화합물의 잠재적 재배치 (예 : 고용량, 조기 및 장기간 노출, 잠재적으로 "풍부한"IVF)를 탐색하고 있습니다. 인구 (즉, ET 시점에 자궁 수축률이 높은 피험자). 이를 위해 2020 년 1 월 13 일에 ObsEva와 Yuyuan BioScience Technology (“Yuyuan”)는 체외 수정 또는 IVF주기의 일환으로 배아 이식을받는 여성의 임상 임신 및 출생률을 개선하기위한 nolasiban을 개발하고 상업화하기위한 재 라이센스 계약을 체결했습니다. 중화 인민 공화국 (PRC). 계약 조건에 따라 Yuyuan은 중국에서 nolasiban을 개발하고 상업화 할 수있는 독점권을 가지고 있습니다. 그들은 중국에서 1 단계 연구와 2 단계 개념 증명 연구에 자금을 지원하고 수행 할 의무를 시작으로 중국의 모든 개발 및 등록 활동에 자금을 지원할 것입니다. 그 후 두 회사는 nolasiban의 글로벌 개발을 위해 협력하지만 ObsEva는 PRC 외부에서 제품에 대한 모든 권리를 보유합니다. 계약 조건에 따라 Yuyuan은 중국에서 nolasiban을 개발하고 상업화 할 수있는 독점권을 가지고 있습니다. 그들은 중국에서 1 단계 연구와 2 단계 개념 증명 연구에 자금을 지원하고 수행 할 의무를 시작으로 중국의 모든 개발 및 등록 활동에 자금을 지원할 것입니다. 그 후 두 회사는 nolasiban의 글로벌 개발을 위해 협력하지만 ObsEva는 PRC 외부에서 제품에 대한 모든 권리를 보유합니다. 계약 조건에 따라 Yuyuan은 중국에서 nolasiban을 개발하고 상업화 할 수있는 독점권을 가지고 있습니다. 그들은 중국에서 1 단계 연구와 2 단계 개념 증명 연구에 자금을 지원하고 수행 할 의무를 시작으로 중국의 모든 개발 및 등록 활동에 자금을 지원할 것입니다. 그 후 두 회사는 nolasiban의 글로벌 개발을 위해 협력하지만 ObsEva는 PRC 외부에서 제품에 대한 모든 권리를 보유합니다
2.Linzagolix – 자궁 내막증
2015 년 ObsEva는 Kissei Pharmaceutical Co.의 Linzagolix 라이선스를 취득했으며, 일본에서 여러 단계 2a 임상 시험을 완료했습니다.
Linzagolix는 새로운 경구 투여 GnRH 수용체 길항제로서 자궁 내막증 관련 통증의 효과적인 관리를 잠재적으로 제공하는 동시에 골밀도 손실 및 현재 승인 된 치료와 일반적으로 관련된 기타 부작용을 완화합니다. 시판되는 GnRH 작용제와 달리 Linzagolix는 하루에 한 번 경구로 투여 할 수 있으며, 증상은 며칠 내에 완화되는 동시에 GnRH 작용제 치료와 관련된 초기 증상 악화를 잠재적으로 완화 할 수 있습니다. Linzagolix는 용량 의존적으로 에스트라 디올 수치를 낮출 가능성이 있으므로 환자의 골밀도 손실을 완화하기 위해 최적의 범위 내에서 이러한 수치를 유지합니다.
완료된 2b 상 EDELWEISS 1 시험, 이중 맹검, 위약 (PBO) 대조 시험은 24 주 동안 50, 75, 100 및 200mg의 linzagolix 용량을 매일 1 회 평가했습니다. 24w에서 피험자는 최대 52w까지 활성 치료를 연장 할 수 있습니다. 일차 평가 변수는 전자 일기를 사용하여 구두 평가 척도로 평가 한 28 일 동안 골반 통증이 30 % 이상 감소한 피험자의 비율이었습니다. 2 차 평가 변수는 월경통, 비 월경 골반통 (NMPP), 성교통, 배변 장애, 혈청 에스트라 디올 (E2), 일상 활동의 어려움, 환자의 전반적인 변화 / 중증도 인상 (PGIC / S), 자궁 내막증 건강 프로필 -30 (EHP)을 포함합니다. -30), 무월경, 이중 에너지 X- 선 흡수 측정법 (DXA)이있는 BMD 및 부작용.
12 주에 PBO에 비해 75mg 이상의 용량에 대해 OPP, DYS 및 NMPP에 대한 응답자의 %가 유의하게 증가했습니다. 이러한 효과는 일반적으로 24 및 52 w에서 유지되거나 증가되었습니다. 12w에서 성교통 (200mg 만 해당)과 배변 장애 점수가 유의하게 개선되었으며 24 주와 52 주에 유지되거나 증가했습니다. 24 주에 평균 BMD 손실 (척추)은 50mg과 75mg 용량에서 1 % 미만이었고 용량이 200mg에 대해 2.6 %까지 증가함에 따라 증가했습니다. 유사한 패턴이 52w에서 관찰되었습니다. 대퇴골과 고관절의 골밀도 변화는 비슷하지만 일반적으로 더 작습니다.
Linzagolix의 일일 용량 75mg 이상은 12 주에 EAP 증상을 크게 개선했으며 이러한 효과는 24 주와 52 주에 유지되거나 증가했습니다. 이 데이터는 저용량 추가 호르몬 요법 (E2 1mg / NETA 0.5mg)과 함께 매일 한 번 linzagolix 75mg과 매일 한 번 200mg을 사용하는 EAP를 가진 여성을 대상으로 한 3 상 시험을 지원합니다.
자궁 내막증에서 위약과 비교하여 Linzagolix의 핵심적인 3 상 EDELWEISS 2 및 3 임상 시험이 미국과 유럽에서 진행 중입니다. EDELWEISS 1 & 2 임상 시험은 자궁 내막증 관련 골반 통증이있는 약 900 명의 여성을 대상으로합니다.
3.EBOPIPRANT (OBE022)
현재까지 조기 진통 (PTL)은 효능이 제한적이거나 안전 문제가 제한적인 치료 만 사용할 수있는 상태입니다. 여기에는 자궁 수축을 억제하고 출산을 지연시키는 데 제한된 효능이있는 토 콜리 틱스의 오프 라벨 사용이 포함됩니다.
에보 피프 란 트 (OBE022)는 염증과 자궁 수축을 줄이고 자궁 경부 변화와 태아 막 파열을 유발하지 않고 예방하여 조기 진통을 조절하도록 설계된 잠재적 인 최초의 새로운 경구 활성 프로스타글란딘 F 2α (PGF 2α ) 수용체 길항제입니다. 인도 메타 신과 같은 비특이적 프로스타글란딘 합성 억제제에서 보이는 태아의 잠재적으로 심각한 혈관 수축 (예 : 동맥관의 조기 폐쇄 및 / 또는 신장 손상).
PROLONG 연구는 자발적인 PTL이 위협받는 임산부를 대상으로 한 에보 피프 란 트의 첫 번째 임상 2 상 개념 증명 시험입니다. 연구는 두 부분으로 진행되었습니다.
PROLONG 파트 A는 9 명의 피험자가 등록 된 임산부에게 7 일 동안 경구 투여 된 에보 피프 란 트의 공개 단일 팔 시험이었습니다. 에보 피프 란 트는 산모와 태아에게 잘 견디며, 에보 피프 란 트의 약동학은 이전에 임신하지 않은 여성에서 관찰 된 것과 유사했습니다.
PROLONG Part B는 에보 피프 란 트의 효능, 안전성 및 약동학을 평가하기위한 무작위, 이중 맹검, 위약 대조, 병행 군 시험이었습니다. 피험자는 임신 24 ~ 34 주 사이에 자발적으로 위협받는 조산을 보이는 임산부였습니다. 또한 조기 진통을위한 표준 치료 요법 인 아토 시반 주입을 48 시간 동안 처방 받아야했습니다.
에보 피프 란 트 또는 위약은 시작 용량으로 1000mg (아토 시반 주입 시작 후 24 시간 이내)으로 경구 투여 한 다음, 7 일 동안 하루에 두 번 500mg을 투여했습니다. 여성은 최대 14 일 (더 빨리 분만하지 않는 한), 분만시, 분만 후 최대 28 일까지 평가를 받았습니다. 생후 6, 12, 24 개월에 영아에 대한 후속 조치가 계속되고 있으며 결과는 2021 년과 2022 년에 확인할 수 있습니다.
이 연구에서 자발적인 조산 (24 주에서 34 주 사이의 임신 연령)을 가진 113 명의 여성을 무작위로 배정하여 7 일 동안 아토 시반 + 에보 피프 란 트 또는 아토 시반 + 위약으로 치료했습니다. 단태 임신을 한 여성은 83 명 (73 %), 쌍태 임신을 한 여성은 30 명 (27 %)이었다. 114 명의 신생아가 태어났습니다.
PROLONG 연구에서 에보 피프 란 트는 투여 시작 후 48 시간에 단태 임신에서 아토 시반 단독에 비해 55 %까지 분만을 줄였습니다. 전반적으로, 에보 피프 란 트를 투여받은 여성의 7/56 (12.5 %)이 치료 시작 후 48 시간 이내에 분만 한 반면, 위약을 투여받은 12/55 (21.8 %)에 비해 (OR 90 % CI : 0.52 (0.22, 1.23)). 단태 임신에서 에보 피프 란 트를 투여받은 여성의 5/40 (12.5 %)은 위약을 투여받은 11/41 (26.8 %)에 비해 48 시간 이내에 분만했습니다 (OR 90 % CI : 0.39 (0.15, 1.04)). 싱글 톤에서 7 일에 배달에 대한 적당한 효과가 나타났습니다.
산모, 태아 및 신생아 이상 반응의 발생률은 에보 피프 란 트 그룹과 위약 그룹의 피험자간에 비슷했습니다.
조산은 긴급한 의학적 개입이 필요한 중요한 상황입니다. 조산과 관련된 사망률과 이환율을 줄이는 주요 목표 중 하나는 최소 48 시간 동안 분만을 지연시켜 신생아의 폐 성숙 및 신경 보호를 유도하는 중요한 약물의 투여와 완전한 효과를 허용하는 것입니다. 고무적인 PROLONG 결과는 자발적으로 위협받는 조산을 보이는 여성과 그 아기에게 새로운 희망을 제공합니다.
48 시간에 에보 피프 란 트에서 나타난 강력한 효과를 바탕으로, 고용량 테스트를 포함한 2b 상 용량 범위 결과는이 제품의 잠재력과 아기를위한 장기적 혜택을보다 완전히 정의하기 위해 2021 년에 시작될 것입니다.
재무 보고서
2020년 3분기
https://www.obseva.com/wp-content/uploads/2020/10/ObsEva-Q3-2020-report.pdf
공식 홈페이지
'미국주식' 카테고리의 다른 글
| [미국 주식 기업 정보] Charah Solutions Inc 샤라 솔루션스 (CHRA) (0) | 2021.02.08 |
|---|---|
| [미국 주식 기업 정보] DBV Technologies DBV 테크놀로지 (DBVT) (0) | 2021.02.08 |
| [미국 주식 기업 정보] Atlantic Power 애틀랜틱 파워 (AT) (0) | 2021.02.08 |
| [미국 주식 기업 정보] Ceragon Networks Ltd 세라곤 네트웍스 (CRNT) (0) | 2021.02.08 |
| [미국 주식 기업 정보] Yield10 Bioscience, Inc. 일드10 바이오사이언스 (YTEN) (0) | 2021.02.06 |




댓글