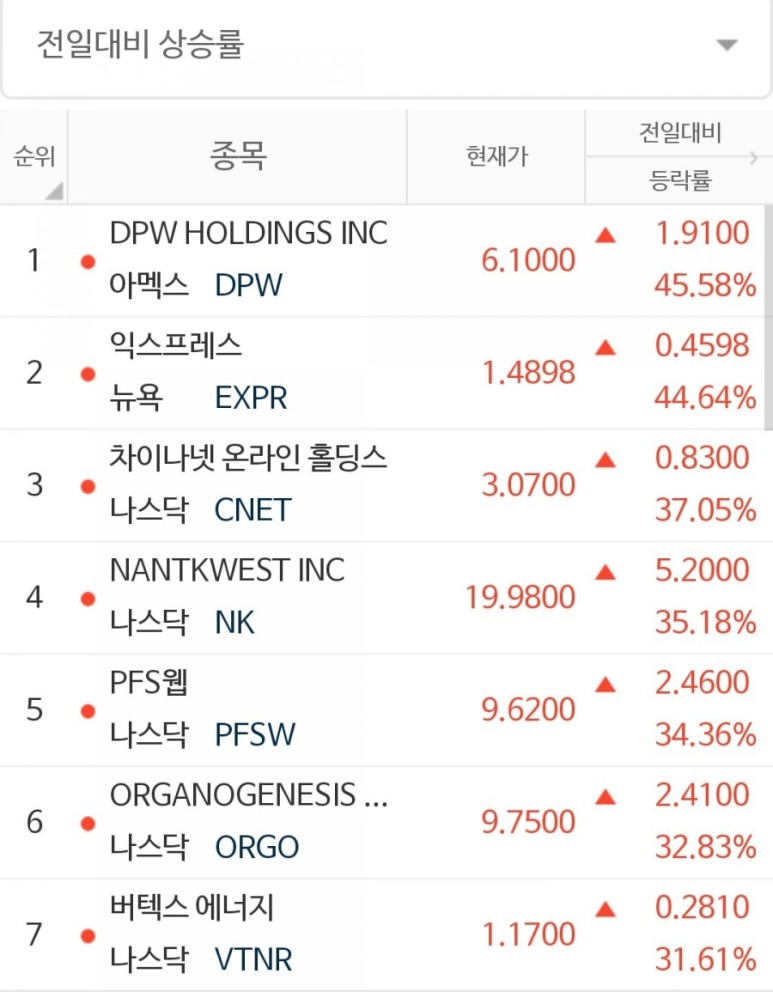
안녕하세요. 옆집 세라입니다. 오늘의 전일대비 상승율 4위는 Nantkwest Inc 가 되겠습니다.
주식이 급등한 이유는?
ImmunityBio와 전이성 췌장암 시험에서 생존율에 대한 긍정적인 중간 데이터를 발표했기 때문
2021 년 1 월 13 일 | 보도 자료
"Cancer Moonshot"전략의 병용 면역 요법에 기반한 Pivotal QUILT 88 시험; 다른 승인 된 치료 옵션이없는 췌장암 환자의 생존율 증가에 대한 조기 징후
2019 년에 완료된 haNK 및 avelumab (PD-L1 체크 포인트 억제제)의 초기 Cancer Moonshot QUILT 시험에서 전체 생존율 중앙값이 기존 대조군에 비해 두 배 이상 증가했습니다 (8 개월 대 3 개월)
haNK 및 PD-L1 체크 포인트 억제제 avelumab을 PD-L1 t-haNK로 대체 할 때 완전한 관해가 달성되었으며, 5 명의 환자 중 4 명은 이러한 확장 된 프로토콜로 치료를 시작한 후 8-16 개월 동안 살아 있습니다.
이 고무적인 초기 데이터를 기반으로 2020 년 10 월에 단일 군 2 상 연구 (QUILT 88, 코호트 C)가 시작되었으며, 1 차 평가 변수는 전체 생존이고 18 명 중 15 명 (83 %)의 환자는 선 이상 췌장암은 현재까지 살아 있습니다.
1 차 및 2 차 췌장암에 대한 무작위 시험은 현재까지 QUILT 88에 등록되었거나 평가중인 환자가 50 명 이상인 3 곳에서 적극적으로 모집하고 있습니다.
EL SEGUNDO와 CULVER CITY, CA, 2021 년 1 월 13 일 – 임상 단계의 자연 살해 세포 기반 치료 회사 인 NantKwest, Inc.와 비상장 면역 요법 회사 인 ImmunityBio, Inc.는 오늘 조기 중간 결과를 발표했습니다. PD-L1 t-haNK 프로토콜의 중앙 생존율은 다른 FDA 승인 치료법이없는 진행성 전이성 췌장암 환자의 역사적 비율보다 두 배 이상 높았습니다. 2017 년에 시작된 최초의 Cancer Moonshot 가설과 탐색 적 QUILT 시험을 기반으로 한이 시험은 Natural Killer 및 T 세포 요법을 조정함으로써 고용량 화학 요법없이 생존율을 향상시킬 수 있다는 이론을 입증하는 것으로 보입니다.
Cancer Moonshot의 초기 공동 연구에는 NantKwest, ImmunityBio, Celgene 및 Pfizer를 비롯한 여러 생명 공학 및 제약 회사의 세포 요법과 면역 요법의 조합이 포함되었습니다. 이 실험은 환자 자신의 면역 체계를 활성화함으로써 암 치료의 패러다임 변화가 고용량 화학 요법없이 암세포를 박멸하도록 진화 할 수 있다는 가설을 탐구했습니다. 2017 년부터 2020 년까지 세포 요법, 면역 조절 항체, 아데노 바이러스 기반 암 백신 및 저용량 화학 요법의 조합을 탐구하는 여러 QUILT 임상 시험에서 중앙 생존율이 두 배 이상이고 완전한 관해가 달성 될 수 있음을 보여주는 예비 결과를 제공했습니다. 다른 FDA 승인 치료 옵션이없는 전이성 췌장암 환자.
중간 연구 결과
2019 년에 완료된 PD-L1 억제제 아벨 루맙과 결합 된 haNK의 Cancer Moonshot QUILT 시험에서 12 명의 환자 연구에서 중앙값 전체 생존율이 두 배 이상 증가했습니다 (이전 대조군 3 개월 대 치료군에서 8 개월). 자세한 내용은 여기 에서 관련 보도 자료 를 참조하십시오.
haNK 및 PD-L1 억제제 avelumab을 PD-L1 t-haNK로 대체했을 때 완전한 관해가 이루어졌으며 아직 중앙 생존 시간 (3 개월)에 도달하지 않은 5 명의 환자 중 4 명은 치료 시작 후 8-16 개월 동안 살아 있습니다. 확장 된 프로토콜
단일 군 2 상 연구 (QUILT 88, 코호트 C)는 2020 년 10 월에 시작되었으며, 1 차 평가 변수는 전체 생존이며 2 차 이상의 췌장암에 등록 된 환자 18 명 중 15 명 (83 %)이 살아남습니다. 현재까지.
1 차 및 2 차 전이성 췌장암에 대한 무작위 2 상 연구 (QUILT 88, 코호트 A 및 B)가 세 곳에서 활발히 등록되고 있습니다.
Cancer Moonshot 프로그램의 목표는 자연 살해 세포와 T 세포를 조율함으로써 암 치료를위한 패러다임 변화가 진화 할 수 있다는 가설을 탐구하는 것이 었습니다. Celgene의 Abraxane, NantKwest의 haNK, ImmunityBio의 Anktiva 및 Pfizer의 PD-L1 억제제 Avelumab을 포함한 면역 치료 분자를 결합한 이러한 Cancer Moonshot 시험의 초기 결과는 다양한 종양 유형에 걸쳐 진행된 전이성 질환이 가능했습니다.”라고 ImmunityBio의 회장 겸 CEO 인 Patrick Soon-Shiong은 말했습니다.
“다른 치료법이없는 5 명의 환자를 위해 우리는 haNK와 avelumab을 임상 NK 세포 요법 인 PD-L1 t-haNK로 대체했고이 병용 치료제를받은 첫 번째 환자에서 완전한 관해를 관찰하게되어 기뻤습니다.”라고 곧 계속되었습니다. -시옹. “현재까지 이들 환자 5 명 중 4 명은 치료를 시작한 이후로 살아 있습니다. 이러한 관찰은 저용량 화학 면역 조절 요법으로 환자 자신의 면역 체계를 활성화하면 결과를 개선 할 수 있다는 우리 가설의 약속을 확인했습니다. 이 데이터는 아직 초기 단계이지만 초기 연구를 기반으로 전이성 췌장암에 대한 QUILT 88 무작위 시험을 시작했으며 오늘 Cohort C 생존율을 포함한 결과를 발표하게 된 것을 기쁘게 생각합니다.
QUILT 88 연구 세부 사항
이 2 상, 무작위, 3 개 코호트, 공개 시험은 PD-L1 t-haNK, Anktiva (N- 803) 및 국소 진행성 또는 전이성 췌장암 환자의 알 독소루비신 (QUILT-88, NCT04390399). 각 치료 설정과 각 1 차 및 2 차 또는 이후 유지 관리 치료는 각각 독립적으로 코호트 A, 코호트 B 및 코호트 C로 평가되며, 코호트 A와 B는 독립적 인 실험 및 대조군 암을가집니다. 이 연구는 처음에 세 코호트 모두에 걸쳐 298 명의 피험자를 등록 할 것입니다. 코호트 A와 B의 주요 목표는 무 진행 생존 (PFS)이고 코호트 C의 목표는 RECIST V1.1에 따른 전체 생존 (OS)입니다.
Cancer Moonshot QUILT 시험 번호에는 QUILT 3.039, 3.060, 3.070 및 3.080이 포함됩니다.
QUILT 88 평가판 사이트 및 등록
현재 캘리포니아 주 오렌지 카운티의 Hoag Memorial Hospital Presbyterian, 캘리포니아 주 로스 앤젤레스 카운티의 Chan Soon-Shiong 의학 연구소, 사우스 다코타 주 수 폴스의 Avera McKennan 병원 및 대학 보건 센터 등 세 개의 시험 사이트가 활성화되었습니다. , 3 개 주 지역 (아이오와, 네브래스카 및 사우스 다코타)의 환자에게 서비스를 제공합니다. 현재 50 명 이상의 환자가 임상 시험에 등록되어 있거나 평가 중입니다.
췌장암은 미국에서 암 관련 사망의 4 번째 주요 원인으로, 2020 년에 약 47,050 명의 사망과 57,600 건의 새로운 사례가 예상됩니다. 전 세계적으로 12 번째로 가장 흔한 암이며 2012 년에 약 338,000 건의 새로운 사례가 진단되었습니다 (2 % 모든 암 진단). 췌장암은 현재까지 계속해서 증가하고 있으며, 2 차 라인을 넘어서는 환자를위한 치료를받을 수 없습니다. 예상 생존 시간이 짧고 기존 동반 질환이 높은 환자에게는 충족되지 않은 분명한 의학적 요구가 존재합니다.
NantKwest 거래
이전에 발표 한 바와 같이 2020 년 12 월 21 일에 ImmunityBio는 NantKwest와 주식 거래를 결합하기로 합의했습니다. 2021 년 상반기에 종료 될 것으로 예상되는이 조합은 종양학 및 전염병에 초점을 맞춘 선도적 인 면역 요법 및 세포 치료 회사를 만들 것입니다.
ImmunityBio 정보
ImmunityBio, Inc.는 암과 전염병을 퇴치하기위한 면역 원성 메커니즘을 구동하는 차세대 치료법을 개발하는 후기 임상 단계의 면역 치료 회사입니다. 이 회사의 면역 치료 플랫폼은 타고난 (자연 살해 세포와 대 식세포) 및 적응 (T- 세포) 면역 시스템을 모두 활성화하여 장기 "면역 기억"을 생성합니다. 이 새로운 접근 방식은 고용량 화학 요법의 필요성을 제거하고 현재 CAR T 세포 요법의 결과를 개선하며 체크 포인트 억제제를 넘어서 확장하도록 설계되었습니다.
ImmunityBio의 플랫폼은 항체 사이토 카인 융합 단백질, 합성 면역 조절제 및 2 세대 인간 아데노 바이러스 (hAd5) 백신 기술의 세 가지 개별 양식을 기반으로합니다.
Anktiva ™ (ImmunityBio의 리드 사이토 카인 주입 단백질)는 새로운 인터루킨 -15 (IL-15) 수퍼 효능 제 복합체이며 BCG 비 반응성 CIS 비 근육 침습에 대해 미국 식품의 약국 (FDA)으로부터 획기적인 치료 및 패스트 트랙 지정을 받았습니다. 방광암 (NMIBC). 이 회사는 또한 회사의 합성 면역 조절제 (Aldoxorubicin)와 조합하여 1 차 및 2 차 폐암, 삼중 음성 유방암, 전이성 췌장암, 재발 성 교 모세포종, 연조직 육종과 같은 적응증에 대한 2 상 또는 3 상 시험을 진행 중입니다. ).
ImmunityBio는 또한 2 세대 인간 아데노 바이러스 (hAd5) 백신 기술로 HIV, 인플루엔자, 코로나 바이러스 SARS-CoV-2의 예방 및 치료를위한 백신을 포함한 치료법을 개발하고 있습니다.
NantKwest, ImmunityBio Announce Positive Interim Data on Survival Rates in Metastatic Pancreatic Cancer Trials - NantKwest
nantkwest.com
기업 정보
NantKwest는 암, 전염병 및 염증성 질환을 치료하기 위해 자연 살해 세포를 사용하여 타고난 면역 체계의 힘을 활용하는 데 중점을 둔 혁신적인 임상 단계 면역 요법 회사입니다.
NantKwest는 암 치료의 현재 패러다임을 바꿀 잠재력을 가진 정밀 암 의학을 구현할 수있는 독보적 인 위치에 있습니다. 자연 살해 세포는 스트레스를 받거나 감염된 세포를 인식하고 감지하도록 설계된 인체의 고대 세포입니다. NantKwest "기성품"활성화 된 Natural Killer (NK) 플랫폼은 신체에서 암과 바이러스에 감염된 세포를 파괴하도록 설계되었습니다. NK 세포의 안전성과 광범위한 암에 대한 활성은 미국, 캐나다 및 유럽의 여러 임상 1 상 시험에서 테스트되었습니다. 외래 환자 환경에서 "기성품"살아있는 약물로 투여 할 수있는 NK 세포 기능 외에도 개별화 된 환자 매칭없이 보편적 인 세포 기반 치료법으로 사용됩니다. 또한, 당사의 NK 세포 기반 플랫폼은 키메라 항원 수용체 (CAR) 및 항체 수용체를 통합하여 잠재적으로 치료 질환의 표적화 및 효능을 더욱 최적화하도록 생체 공학적으로 설계되었습니다.
2020년 3분기 회사 프레젠 자료
https://nantkwest.com/wp-content/uploads/2020/11/NantKwest-Corporate-Deck-v15-11-9-20lr.pdf
공식 홈페이지
NantKwest - Cellular Therapies
NantKwest: NK-92 ®️ Cells - NantKwest is developing pioneering cellular therapies that improve the body's innate immune system to treat cancers, infectious diseases and inflammator
nantkwest.com
문의처
https://ir.nantkwest.com/shareholder-services/document-request
'미국주식' 카테고리의 다른 글
| [미국 주식 기업 정보] Affirm Holdings Inc 어펌 홀딩스 (AFRM) (0) | 2021.02.08 |
|---|---|
| [미국 주식 기업 정보] Express, Inc. 익스프레스 (EXPR) (0) | 2021.02.08 |
| [미국 주식 기업 정보] Datasea Inc. 데이터씨 (DTSS) (0) | 2021.02.08 |
| [미국 주식 기업 정보] Vertex Energy Inc 버텍스 에너지 (0) | 2021.02.08 |
| [미국 주식 기업 정보] Charah Solutions Inc 샤라 솔루션스 (CHRA) (0) | 2021.02.08 |




댓글